Les CAR T-Cells réservés aux établissements de santé qualifiés
L'arrêté du 28 Mars 2019 précise les critères d'autorisation des établissements de santé prescripteurs de traitements par les cellules CAR T (Médicaments de thérapie Innovante) et définit le rôle des pharmacies à usage intérieur (PUI) concernées.
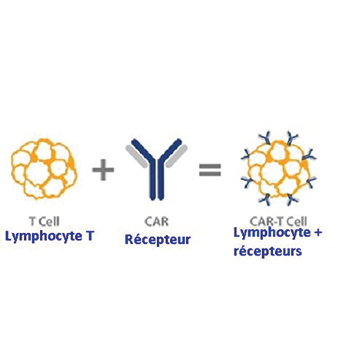
Les CAR T-Cells , sont des médicaments de thérapie génique constitués de cellules T génétiquement modifiées, de manière à leur conférer une efficacité anti-tumorale. En juin 2018, l'Agence européenne des médicaments (EMA) a rendu un avis positif pour l'autorisation de mise sur le marché (AMM) des deux premiers médicaments de thérapie génique Kymriah (Novartis) et Yescarta (Gilead), destinés aux traitements de certains cancers hématologiques, chez des patients en situation d'impasse thérapeutique. L'arrêté du 28 mars 2019 , publié au Journal officiel du 10 avril 2019, définit les critères auxquels doivent répondre les établissements de santé autorisés à prélever et à administrer ces CAR T-Cells. Le texte rappelle notamment que pour pouvoir administrer cette thérapie l'établissement de santé doit disposer d'une pharmacie à usage intérieur (PUI) responsable de l'approvisionnement, de la gestion, de la préparation, du contrôle, de la détention et de la dispensation des médicaments de thérapie innovante. L'arrêté précise également le rôle de la PUI qui doit " organise [r] dans ses locaux notamment, la réception, la conservation et la mise en forme en vue de l'administration au patient avant délivrance et transport dans les conditions spécifiées par l'autorisation de mise sur le marché ".
