Produits de contraste à base de gadolinium et rétention de gadolinium dans le cerveau et dans d'autres tissus : modification des AMM

En accord avec l'Agence Européenne des Médicaments (EMA) et l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), les laboratoires titulaires d'une AMM des produits de contraste à base de gadolinium souhaitent vous faire part des informations suivantes :
- Une revue par l’Agence Européenne des Médicaments (EMA) a confirmé que de faibles quantités de gadolinium sont retenues dans le tissu cérébral après l’utilisation de produits de contraste à base de gadolinium.
- Une rétention plus importante de gadolinium dans le cerveau a été observée avec les produits linéaires par rapport aux produits macrocycliques.
- À ce jour, il n’existe aucune preuve que la rétention de gadolinium dans le cerveau, quel que soit le produit de contraste, soit nocive pour les patients.
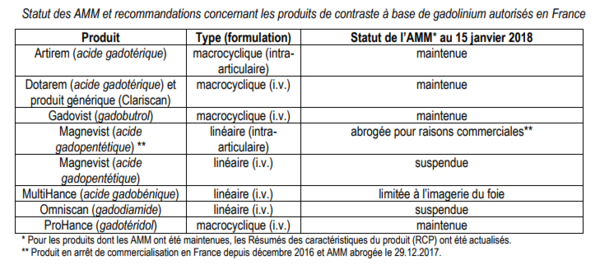
- Comme les risques à long terme de la rétention de gadolinium dans le tissu cérébral sont inconnus, l’EMA recommande la suspension des AMM des produits de contraste linéaires intraveineux dans l’UE, à l’exception :
- de l’AMM de l’acide gadobénique, qui reste disponible pour l’imagerie du foie uniquement. - - de l’AMM de l’acide gadopentétique, pour l’utilisation intra-articulaire uniquement (Ce médicament n’est néanmoins plus commercialisé en France depuis décembre 2016 et son AMM vient d’être abrogée pour raisons commerciales).
- Les AMM du produit linéaire intraveineux gadodiamide et des formulations intraveineuses de l’acide gadopentétique sont suspendues à compter du 15 janvier 2018.
- Les produits macrocycliques restent également disponibles, pour les utilisations intraveineuse et intra-articulaire.
- Il est rappelé aux professionnels de santé qu’ils doivent utiliser des produits de contraste à base de gadolinium uniquement lorsque l’information diagnostique essentielle ne peut être obtenue par l’imagerie sans rehaussement de contraste.
> Lettre aux professionnels de santé