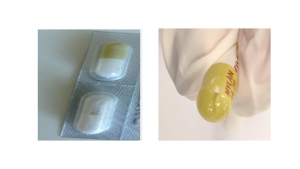
Lénalidomide : n’ouvrez pas les plaquettes des gélules qui paraissent endommagées

Le laboratoire Viatris a informé l'ANSM de la découverte de gélules endommagées dans des plaquettes de lénalidomide. Tous les dosages peuvent être concernés par ce défaut qualité qui est visible du fait de la présence de poudre dans l’alvéole plastique, autour de la gélule.
Aucun lot n’est rappelé afin d’éviter une rupture de stock. L'ANSM met en place des contrôles afin d’éviter que des boîtes contenant des gélules endommagées ne parviennent aux patients, à leurs proches et à leurs aidants : l'ANSM demande au laboratoire Viatris d’ouvrir et de contrôler systématiquement les boîtes avant leur distribution aux établissements de santé concernés et aux pharmaciens hospitaliers de réaliser ce même contrôle visuel avant leur envoi dans les services de soin ou leur dispensation aux patients..
L'ANSM alerte les soignants, les aidants et les proches des patients sur les risques associés à la manipulation des gélules de lénalidomide : les femmes enceintes ou en âge d’avoir des enfants ne doivent pas entrer en contact avec la poudre de ce médicament car il présente un risque tératogène connu, c’est-à-dire qu’il peut provoquer des malformations ou le décès du fœtus.
L'ANSM a demandé aux autres laboratoires commercialisant du lénalidomide de procéder à des investigations, par mesure de précaution. Les recommandations de l'ANSM seront actualisées en fonction des résultats.
L'ANSM invite toute personne amenée à manipuler les plaquettes de lénalidomide à redoubler de vigilance et à suivre strictement les recommandations de sécurité rappelées ci-dessous.
- Retrouvez les informations pour les soignants, aidants et proches des patients
- Retrouvez les informations pour les pharmaciens hospitaliers
- Retrouvez les informations pour les patients
Le lénalidomide est un médicament utilisé dans le traitement de cancers du sang (myélomes, lymphomes). Il est tératogène, c’est-à-dire qu’il peut provoquer des malformations graves voire le décès du fœtus. Les femmes enceintes ou en âge d’avoir des enfants ne doivent en aucun cas entrer en contact avec ce produit. Toute exposition pendant la grossesse (y compris les suspicions de grossesse, absence de règles et tous saignements menstruels inhabituels) doit faire l’objet d’une consultation médicale et doit être signalée au centre régional de pharmacovigilance ou sur signalement.social-sante.gouv.fr.
Ce défaut qualité survient dans un contexte de tension d’approvisionnement en lénalidomide sur certains dosages. En l’absence d’alternatives en quantité suffisante, les lots des médicaments concernés ne sont pas rappelés afin d’éviter une rupture de stock. En revanche, l'ANSM met en place une vérification en cascade :
- L'ANSM demande au laboratoire Viatris de contrôler toutes les boîtes avant leur distribution aux pharmacies hospitalières (PUI) ;
- L'ANSM demande également aux pharmaciens des PUI, avant chaque dispensation aux patients, d’ouvrir les boîtes de lénalidomide et de vérifier l’absence de poudre dans les alvéoles ;
- Dans les services de soins utilisant ce médicament, une ultime vérification doit aussi être réalisée par les soignants avant ouverture de la plaquette. Les consignes rappelées en encadré doivent être scrupuleusement suivies.
Un courrier d’information destiné aux patients et à leurs aidants sera également joint, par le laboratoire, aux boîtes de médicaments, afin de les informer du défaut qualité et leur rappeler les consignes de sécurité liées à la manipulation de ce médicament.
L’origine du défaut qualité a été identifiée par le laboratoire et est en cours de résolution. Les investigations menées par le laboratoire, ont mis en évidence que tous les lots peuvent être concernés par ce problème dont la fréquence reste faible. Ce problème pouvant toucher d’autres laboratoires, l'ANSM leur a demandé de procéder aux mêmes investigations, par mesure de précaution.
Informations pour les soignants, aidants et proches des patients
Pour rappel, le lénalidomide est un médicament tératogène : il peut provoquer des malformations graves chez le fœtus.
Avant toute dispensation, le pharmacien hospitalier contrôlera la boîte de lénalidomide et l’ouvrira avant de vous la remettre afin de s’assurer qu’aucune gélule n’est endommagée. Il vous remettra, avec le médicament, un courrier d’information du laboratoire Viatris. Prenez-en connaissance avant de manipuler votre boîte de médicaments.
Avant d’ouvrir une alvéole pour prendre une gélule, vérifiez qu’elle ne semble pas contenir de poudre libre et que toutes les gélules de la plaquette sont intactes. Si vous observez de la poudre ou si une gélule est fissurée, n’ouvrez pas la plaquette et rapportez la boîte à votre pharmacien hospitalier.
Si vous êtes ou pensez être enceinte et que vous avez été en contact avec de la poudre de lénalidomide, prévenez immédiatement votre médecin. Il vous orientera vers un médecin spécialiste. Ce dernier évaluera s’il est nécessaire de réaliser des examens complémentaires.
Précautions de manipulation
Les femmes enceintes ou en âge d’avoir des enfants ne doivent pas entrer en contact avec ce produit.
L'ANSM rappelle que vous devez mettre des gants jetables avant toute manipulation des plaquettes ou des gélules de lénalidomide. Retirez ensuite les gants avec précaution, jetez-les immédiatement et lavez-vous soigneusement les mains au savon et à l’eau.
Informations pour les pharmaciens hospitaliers
Contrôle des boîtes
Viatris ayant déjà procédé à un premier contrôle avant envoi, certaines boîtes de lénalidomide que vous recevrez pourraient ne plus comporter de dispositif anti-effraction.
Lors de chaque dispensation, l'ANSM demande d’ouvrir les boîtes de lénalidomide pour vérifier l’intégrité des gélules ainsi que l’absence de poudre dans les alvéoles des plaquettes.
Si une gélule est fissurée ou qu’il y a de la poudre dans une alvéole, détruisez la boîte concernée.
Dispensez aux patients une boîte sans ce défaut qualité et remettez-leur systématiquement le courrier du laboratoire en leur rappelant les recommandations de sécurité. Informez les patients que s’ils aperçoivent de la poudre dans une alvéole, ils ne doivent pas l’ouvrir et vous rapporter la boîte pour échange.
- Consultez le courrier du laboratoire à destination des pharmaciens de PUI
- Consultez le courrier du laboratoire à destination des patients et leurs aidants
Précautions de manipulation
L'ANSM rappelle qu’il est recommandé de porter des gants jetables au moment de la manipulation des plaquettes ou des gélules de lénalidomide. Retirez ensuite les gants avec précaution, jetez-les immédiatement et lavez-vous soigneusement les mains au savon et à l’eau. Ne manipulez pas les plaquettes ou les gélules si vous êtes enceinte ou susceptible de l'être.
Informations pour les patients
Si vous êtes en possession d’une boîte de lénalidomide Viatris, n’arrêtez pas ou ne modifiez pas votre traitement sans l’avis de votre médecin.
Avant de prendre vos gélules, vérifiez que les alvéoles ne contiennent pas de poudre et que toutes les gélules sont intactes. Si vous observez de la poudre ou une gélule endommagée, n’ouvrez pas l’alvéole concernée et rapportez la boîte à votre pharmacien hospitalier qui vous en délivrera une nouvelle.
Pour toute nouvelle dispensation, votre pharmacien hospitalier doit contrôler la boîte de lénalidomide avant de vous la remettre afin de s’assurer qu’aucune gélule n’est endommagée ; la boîte que vous recevrez aura donc déjà été ouverte. Votre pharmacien vous délivrera également un courrier d’information fourni par le laboratoire Viatris. Prenez-en connaissance avant d’ouvrir votre boîte de médicaments.